Сульфоалюминатные цементы
Сульфоалюминатные цементы
При изучении системы CaO—AI2O3—CaSC>4 было обнаружено новое соединение ЗСаО • 3AI2O3 • CaS04, названное сульфо-алюминатом кальция. Соответственно цементы, содержащие этот минерал, называют сульфоалюминатными.
Кинетика и последовательность минералообразоваиия в системе СаО—А^Оз—СаБО^ Процессы минералообразоваиия при обжиге смесей портландцементного клинкера завершаются в клинкерном расплаве. Получение сульфоалюминатного клинкера характеризуется реакциями без участия расплава.
Характерной особенностью реакций с участием твердых веществ является локализация реакционной зоны на поверхности раздела фаз исходного твердого вещества и твердого продукта реакции. Такая поверхность образуется и изменяется в результате химического процесса, скорость которого зависит от ряда факторов (времени, температуры и т. д.).
В течение многих лет вопросу кинетических закономерностей топохимических реакций уделялось большое внимание и к настоящему времени топохимическую реакцию представляют в виде процесса, состоящего из нескольких стадий: образования отдельных атомов (молекул) твердого продукта на поверхности твердого реагента; возникновения ядер фазы твердого продукта; роста ядер; образования слоя продукта реакции, толщина которого зависит от времени протекания процесса. В соответствии с такой стадийностью скорость процесса изменяется в зависимости от степени вклада каждой стадии процесса. Первые кинетические зависимости процесса взаимодействия твердых веществ были установлены Тамманом, Лидером, П. П. Буднико-вым, А. М. Гинсткингом и др.
Многообразие уравнений кинетики твердофазовых процессов является отображением многообразия моделей физико-химических механизмов в конденсированных системах. В связи с этим неоднократно делались попытки найти общие безмодельные принципы построения химической кинетики гетерогенных реакций. В частности, еще в 1940 г. Н. С. Акулов, рассматривая гомогенные и гетерогенные реакции, установил, что основной «двигательной» силой реакций служат процессы автогенезиса и автокатализа.
Действительно, образование сульфоалюмината кальция ускоряется, если в качестве глиноземистого компонента взят Al2(S04)3- Результаты определения реакционной способности различных смесей в соответствии с уравнением Таммана — Фишбека приведены в табл. 3.6.
Константа скорости реакции синтеза C3A3CS в системах CaC03-Al2(S04)3 и Ca(OH)2~Al2(S04)3 в 2 раза больше константы скорости образования C3A3CS в смеси на основе А1203.
Анализ данных табл. 3.6 показывает, что наибольшей_ско-ростью взаимодействия компонентов при синтезе C3A3CS характеризуются смеси Са(ОН)2 с А1(ОН)з или A123- Энергия активации реакции образования C3A3CS в первом случае равна 56,6 кДж/моль, во втором— 61,7 кДж/моль, т. е._в 1,4— 1,26 раза ниже энергии активации образования C3A3CS в системе СаС03 – А1203 – CaS04.
Фазовый состав клинкеров. Последовательность реакций и формирование фазового состава при обжиге смеси, рассчитанной на получение сульфоалюмината кальция, можно схематично записать следующим образом: первоначально образуются алюминаты кальция, при взаимодействии которых с гипсом образуется сульфоалюминат кальция.
Состав новообразований при обжиге в системе СаСОз — А12Оз ~ CaS04, можно изучать рентгенографическим, химическим, ИК-спектроскопическим и микроскопическим методами анализа.
ИК-спектр исходной смеси содержит полосы, характерные для отдельных компонентов. Так, полосы 740 и 790 см (валентные колебания А1 —О связи), 960 и 1040 см-1 (деформационные колебания ОН), 3987, 3459, 3527 и 3626 см (валентные колебания ОН) определяют гидроксид алюминия; полосы 967 и 1430 см (деформационные и валентные колебания СОз), 594, 600 и 1110—1140 см-1 (асимметричные и симметричные валентные колебания сульфогруппы), 1614—1678 см-1 (деформационные колебания ОН) характерны для гипса CaS04 • 2Н20. В области валентных колебаний ОН наблюдается уширение (3400 см), что свойственно для молекулярной воды. Обжиг при 800 °С сопровождается появлением новых полос 820 и 875 см и полос в области 600—700 см, указывающих на образование алюминатов кальция. Повышение температуры обжига до 1000 °С обусловлено увеличением количества алюминатов кальция, о чем можно судить по росту интенсивности полос 820, 875 и 675 см, и началом образования C3A3CS, которое фиксируется по сдвигу и видоизменению полос, принадлежащих сульфо-группе (в областях 600—700 и 1100—1200 см), а также появлению полосы 475 см. ИК-спектр образца, обожженного при 1400 °С, характеризуется полным исчезновением полос 867 и 1430 см (разложение карбоната) и наличием интенсивных полос 475, 625, 650, 675 и 1150 см, свойственных C3A3CS.
Электронно-микроскопические исследования позволяют наблюдать границу зерен, форму, величину и взаимное расположение отдельных компонентов, слагающих минеральные агрегаты, которые получаются в процессе обжига и изменяются по мере повышения температуры.
Исходная сырьевая смесь представлена в виде зерен таблитчатой формы и агрегатов бесформенной массы. При 800 °С на поверхности скола клинкера видна форма ступенек скольжения, образованных системой плоских дислокаций, и округлые кристаллы со следами винтового роста, отнесенные, по данным рентгенографического анализа, к СаО. Обожженный при 900 °С образец состоит из пластинчатых Рис кристаллов, а отдельные участки скола — из кристаллов со следами ступенчатой дислокации. С повышением температуры до 1000—1100 °С на стыке дислокаций наблюдается появление кристаллов округлой и гексагональной форм, размер которых увеличивается с повышением температуры до 1200 °С. При этом наблюдается оплавление некоторых кристаллов. По данным высокотемпературного ДТА, первые порции расплава появляются при 1150 °С, при 1300 °С оплавление кристаллов усиливается и распространяется на весь образец, обожженный при 1400 °С.
Образование сульфоалюмината кальция можно изучать и химическим методом. Небольшое количество СаОсв в образцах обнаруживается уже при 600 °С. По мере увеличения температуры количество оксида кальция растет, достигая максимума при 800 °С. За счет взаимодействия AI2O3 и образования С12А7 и СА содержание СаОсв в системе уменьшается.
При замене СаСОз на Са(ОН)2 в сырьевой смеси образование C3A3CS наблюдается уже при 800 °С. Реакционная способность Са(ОН)2 выше чем СаСОз, это и способствует более раннему синтезу C3A3CS. Последовательность минералообразо-вания за счет замены известкового компонента не изменяется (в порядке появления): С12А7, CA, C3A3CS.
Таким образом, при обжиге смеси, содержащей известковый, глиноземистый и сульфатный компоненты, первичной фазой является СА. В зависимости от насыщенности системы известью и от наличия в ней сульфатов на основе СА образуются .алюминаты различной основности и сульфоалюми-нат кальция.
Синтез сульфоалюмината кальция в присутствии оксидов железа и кремния. В присутствии 1—4 мас.% оксида железа обжиг сульфоалюмината кальция не сопровождается каким-либо изменением фазового состава спека. На рентгенограммах образцов (рис. 3.2) снижение интенсивности дифракционных ли
ний, характерных для C3A3CS, не наблюдается. С увеличением добавки Fe2C>3 (более 4 мас.) количество C3A3CS в спеке уменьшается и появляется алюмоферрит кальция, о чем свидетельствует снижение интенсивности линий сульфоалюмината кальция (0,375, 0,265 и 0,216 нм) и появление дифракционных линий 0,725 и 0,192 нм. Методом электронного микрозонда установлено, что распределение Fe в образце в основном равномерное лишь на отдельных участках (на стыке кристаллов, вокруг пор) наблюдается большая концентрация Fe, наряду с Са и А1, что, возможно, указывает на наличие в этих местах алюмоферритов кальция.
Присутствие SiC>2 в C3A3CS оказывает более сильное влияние на образование C3A3CS. Так, при содержании Si02 в количестве, равном 2 мас., наблюдается снижение количества C3A3CS в спеке пропорционально количеству введенного кремнезема. Одновременно^ на дифрактограмме образцов видны аналитические линии CS (0,35, 0,186 и 0,164) и СА2 (0,443 и 2,06 нм). Реакция взаимодействия соединений протекает следующим образом:
C3A3CS + Si02 -* C2AS + CA2 + CS.
Однако, при добавлении в сырьевую смесь СаО в количестве, необходимом для связывания кремнезема в C2S, содержание C3A3CS в спеке не изменяется. Следовательно, разложение C3A3CS, имевшее место под воздействием кремнезема, в присутствии извести не наблюдается.
В системе СаО —Si02 при наличии CaS04, наряду с C2S может образоваться сульфосиликат. В процессе обжига смеси, состоящей из СаСОз, Si02 и CaS04 • 2Н2О, первоначально формируется C2S, а при 1000 °С — сульфосиликат кальция. Максимальное количество этого соединения наблюдается при 1200 °С, к 1300 °С оно разлагается с выделением CaS04 и C2S.
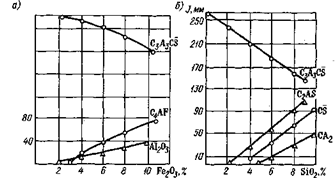
Рис. 3.2. Изменение интенсивности аналитических линий соединений при обжиге
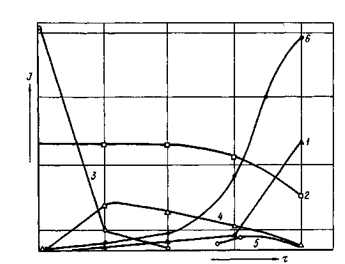
Рис. 3.3. Изменение интенсивности аналитических линий минералов при обжиге смеси
Определение кинетики силикатообразования при обжиге смеси 4CaC03 + 2Si02 + CaS04 • 2Н2О показывает, что процесс может быть описан уравнением Таммана — Фишбека. Энергия активации образования сульфосиликата кальция составляет 179 кДж/моль, а реакции диссоциации CaS04—94,4 кДж/моль.
При наличии в сырьевой смеси AI2O3, CaO, SiC>2, CaS04 (рис. 3.3) первыми продуктами обжига являются C2S и CA(Ci2A7), синтез которых идет параллельно. После образования некоторого количества C2S в результате его взаимодействия с гипсом появляется сульфосиликат кальция. В этот период продолжается образование СА, а затем начинается взаимодействие СА с CaSC>4 с формированием C3A3CS. При разложении сульфосиликата кальция (1300 °С) спек представлен следующими фазами: С12А7, CA, C3A3CS, CS и C2S. Повышение температуры больше 1350 °С сопровождается разложением CS.
При взаимодействии с AI2O3 сульфосиликат кальция может разложиться с образованием C2S и CaS04- В присутствии клинкерных минералов C3A3CS очень устойчив.
Технология сульфоалюминатного клинкера и цемента. Требования, предъявляемые к сырьевым материалам при производстве цемента, обусловлены необходимостью обеспечения выпуска продукта определенного минералогического состава, предопределяющего его свойства. Первичную оценку качества сырья, предназначенного для производства обычного портландцемент-ного клинкера, в настоящее время проводят согласно техническим условиям. Химический состав сырья нормируется как по полезной части (CaO, S1O2, AI2O3 и БегОз), так и по примесям (MgO, SO3, K20 + NaO и Р2О5). Карбонатный компонент по техническим условиям должен содержать не менее 45% СаО. Предельно допустимое содержание примесей в карбонатном компоненте дифференцировано с учетом их количественного содержания в глиноземистом компоненте.
Основные сырьевые материалы для производства сульфоалюминатного клинкера следующие:
кальцийсодержащие породы — известняк, мел;
сульфатсодержащие компоненты — гипс, фосфогипс, фторан-гидрит;
глиноземсодержащие природные материалы — боксит, каолинит, алуниты, высокоалюминатные глины, а также отходы нефтехимической и химической промышленности, черной и цветной металлургии с повышенным количеством AI2O3.
Применяя известную терминологию, принятую при оценке портландцементного сырья, можно отметить, что полезными оксидами в сырьевых материалах для САК являются СаО, AI2O3, примесными — Si02, РегОз, MgO, P2O, Р2О5 и т. д.
Основное внимание при установлении требований к химическому составу сырья должно быть уделено содержанию Si02 и Fe203, поскольку эти оксиды при синтезе сульфоалюмината кальция препятствуют его образованию, связывая СаО и AI2O3 в гидравлически малоактивные соединения C2AS и C4AF. Хотя при избытке довести образуется не C2AS, a C2S, общее содержание C3A3CS в клинкере в присутствии Si02 снижается, во-первых, за счет перераспределения оксидов в сырьевой смеси, во-вторых, за счет внедрения части AI2O3 в кристаллическую решетку C2S.
Пригодность сырьевых компонентов оценивают по величине максимально достижимого количества C3A3CS в клинкере при их использовании. Общее содержание C3A3CS, мас.%, определяют по формуле
C3A3CS = 100 aict2bib2CiC2,
где я1( а2, &i, Ь2, с± и с2 — поправочные коэффициенты, учитывающие количество Si02 («1, bj, Ci) и Fe203 (а2, b2, c2) в кальциевом, алюминатном и сульфатном компонентах.
Изменение величин коэффициентов в зависимости от содержания оксидов кремния и железа в указанных компонентах видно из табл. 3.7.
Таблица 3.7. Значение коэффициентов alf a2, b^, b2, c-i и с2 при различном содержании примесных окислов в компонентах
Колебания в составе алюминатного компонента в большей степени отражаются на содержании C3A3CS в клинкере по сравнению с другими компонентами.
Как видно из представленных в таблицах данных, на основе чистых разностей сульфатного и алюминатного компонентов возможно получение клинкера с высоким содержанием C3A3CS (81—99%), даже при наличии примесных оксидов в карбонатных материалах. В зависимости от состава алюминатного компонента в клинкере на основе чистых сульфатного и карбонатного компонентов содержится от 15 до 100% C3A3CS.